Первое за 20 лет лекарство от болезни Альцгеймера. США одобрили препарат адуканумаб

Американское управление по надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило препарат адуканумаб для борьбы с болезнью Альцгеймера. Это произошло впервые за 20 лет.
Препарат, разработанный компанией Biogen, поступит в продажу под коммерческим названием Aduhelm.
Препарат воздействует на глубинные причины, а не на симптомы болезни Альцгеймера, самого распространенного вида старческой деменции.
Адуканумаб разрушает амилоид — белок, формирующий в мозгу человека сгустки, повреждающие клетки и вызывающие проблемы с памятью, мышлением и общением.
Более 30 миллионов людей в мире, подавляющее большинство из которых старше 65 лет, предположительно страдают болезнью Альцгеймера.
Адуканумаб подходит пациентам моложе 80 лет и с начальной стадией болезни. Потребуется также установить точный диагноз при помощи детального МРТ-сканирования.
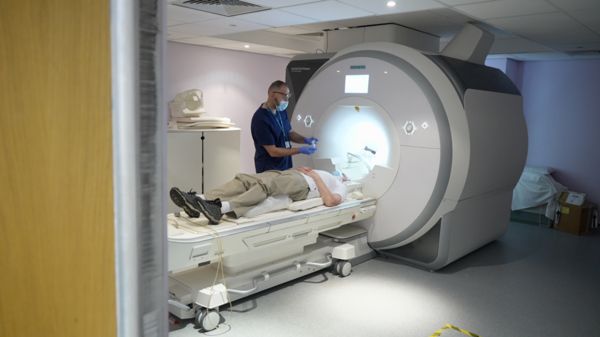
В последние 10 лет рассматривались свыше ста средств лечения болезни Альцгеймера, но ни одно себя не оправдало.
Адуканумаб — не панацея, и немало врачей выражают сомнение в его достоинствах. Но его регистрация в США даст сильный толчок исследованиям в области борьбы с деменцией, традиционно недофинансируемым в сравнении с онкологией или кардиологией.
В марте 2019 года международные испытания адуманукаба с участием трех тысяч человек были прерваны на завершающей стадии, когда выяснилось, что препарат, получаемый в виде ежемесячной инъекции, не дает положительного результата по сравнению с плацебо.
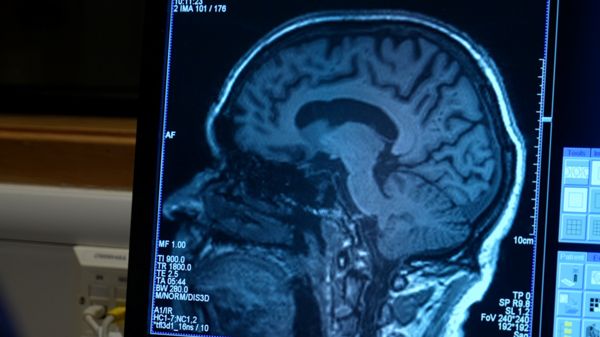
Однако в конце того же года американский производитель Biogen проанализировал больший объем данных и установил, что адуканумаб существенно замедляет ослабление когнитивных способностей, если применяется в более высоких дозах.

Comments are closed.